미국 식품의약국(FDA)이 7일(현지시간) 18년 만에 알츠하이머병 신약을 승인했다. 알츠하이머병 치료제가 치매 증상의 일시적 개선이 아니라 병의 진행을 늦추는 효과로 승인을 받은 것은 이번이 처음이다. 이 약이 전문가 사이에서 일고 있는 효능 논란을 불식시킬 경우 근본적 치료제를 손 꼽아 기다려 온 알츠하이머병 환자에게는 희소식이 될 것으로 예상된다. 또 신약 개발에 힘을 쏟고 있는 국내 제약·바이오 업체의 개발 속도가 한층 빨라지고 보건당국의 승인 기대감도 커질 것으로 관측된다.
외신에 따르면 FDA는 이날 미 제약사 바이오젠과 일본 제약업체 에자이가 공동으로 개발한 알츠하이머병 신약 ‘아두카누맙’을 조건부 승인했다. FDA가 알츠하이머병 신약을 승인한 것은 지난 2003년 이후 18년 만이다. 아두카누맙은 뇌 신경 세포 표면에 쌓여 알츠하이머병 발병을 유발할 수도 있는 ‘베타-아밀로이드’ 단백질 덩어리의 제거를 돕는 것을 목표로 한다. 임상 2건 중 1건에서 이 약을 투여한 환자의 사고 능력 저하가 대조군보다 22% 덜했다는 게 바이오젠의 설명이다.
로이터통신은 이와 관련, 병의 근본적 원인에 대응하기 위해 개발된 신약이 승인 받은 것은 처음이라고 평가했다. 병의 진행 자체를 늦춘 것을 근본적 치료로 본 것이다. 현재까지 나온 치료제는 모두 불면증과 인지 장애 등의 증상을 개선용이다. 알츠하이머병은 기억·추론·의사소통·기본적 일상 업무에 필요한 뇌의 영역을 서서히 공격하는 것으로 알려져 있다.
하지만 적지 않은 전문가가 ‘애듀헬름’이라는 이름으로 판매될 이 약의 효능에 대해 의문을 제기하고 있다. 펜실베이니아대 알츠하이머병 전문가인 제이슨 칼라위시는 월스트리트저널에 “확실한 증거가 없는 상황에서 FDA가 이 약을 승인하지 말았어야 했다”고 지적했다. FDA의 외부 전문가 자문위도 지난해 11월 “설득력 있는 증거가 없다”면서 FDA에 에듀헬름의 승인을 권고하지 않기로 했다. FDA도 이런 논란을 의식한듯 승인을 하면서 바이오젠으로 하여금 효능 확인을 위한 후속 연구 진행을 조건으로 부과했다.
효능이 입증될 경우 알츠하이머병 환자에게는 희소식이 아닐 수 없다. 다만 1인당 연간 약 6,000만원에 달하는 약 값은 부담이 될 수 밖에 없을 것으로 보인다. 한 바이오 업체 관계자는 “미국 업체 약을 미국 FDA가 승인한 것”이라며 “국내 승인은 또 다른 얘기”라고 말했다. 이어 “국내에 도입된다손 치더라도 건강보험 적용이 되지 않으면 약을 쓸 수 있는 사람은 소수에 한정될 것”이라고 덧붙였다.
업계에서는 FDA의 이번 승인이 아리바이오, 젬백스 등 국내 제약·바이오의 알츠하이머병 신약 개발에도 힘을 실을 것으로 보고 있다. 아리바이오는 글로벌 2상을 종료한 상태다. 신약 개발 외에 국내 위탁생산(CMO) 사업에도 도움이 될 것으로 본다. 시장에서는 벌써부터 삼성바이오로직스(207940)가 에듀헬름 위탁생산(CMO)을 맡지 않겠냐는 관측도 나온다.
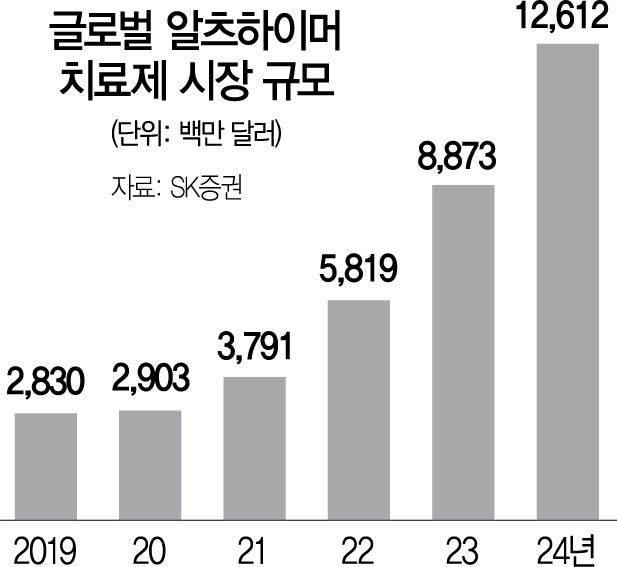
바이오 업계 관계자는 “고령화로 알츠하이머병 치료제 시장은 커지고 있지만 알츠하이머병은 지금까지 난공불락이었던 게 사실”이라며 “성공 사례가 나오면 아무래도 연구개발 투자가 늘어날 것이고 그렇게 되면 또 다른 성공 사례가 나오기도 쉬울 것”이라고 말했다.
/임지훈 기자 jhlim@
- 임지훈 기자
- jhlim@sedaily.com










